蛋白质印迹(Western blot)实验方案
发布时间:2022-06-15 13:36:29 点击:1493
我们的 western blot 实验方案包含溶液、试剂、检测步骤和有用的链接,可指导您完成整个实验。
2020 年 12 月 14 日审核
Western blot 是一项通过凝胶电泳按照分子量大小分离蛋白,然后再利用特异性抗体识别这些蛋白的技术。免疫检测通常使用由硝酸纤维素或 PVDF(聚偏二氟乙烯)制成的膜。将凝胶紧贴膜放置,蛋白在电流作用下从凝胶迁移到膜上。然后利用目标靶点特异性抗体对膜做进一步处理,再通过二抗和检测试剂让膜显色。
目录
如需提升 western blot 分析技能,请查看我们的免费 western blot 培训(可点播)。
溶液与试剂:裂解缓冲液
这些缓冲液在 4 ℃ 下可保存数周,也可分装后在 -20 ℃ 下保存长达 1 年。
NP-40 缓冲液
150 mM 氯化钠
1.0% NP-40(可用 0.1% Triton X-100 代替)
50 mM Tris-HCl,pH 8.0
蛋白酶抑制剂
RIPA 缓冲液(放射免疫沉淀检测缓冲液)
150 mM 氯化钠
1% IGEPAL CA-630
0.5% 脱氧胆酸钠
0.1% SDS(十二烷基硫酸钠)
50 mM Tris-HCl,pH 8.0
蛋白酶抑制剂
Tris-HCl
20 mM Tris-HCl(三羟甲基氨基甲烷盐酸盐)
蛋白酶抑制剂
溶液与试剂:电泳、转膜及封闭缓冲液
Laemmli 2X缓冲液/上样缓冲液
4% SDS
10% 2-巯基乙醇
20% 甘油
0.004% 溴酚蓝
0.125 M Tris-HCl
测定 pH 值并将 pH 值调整至 6.8
电泳缓冲液(Tris-Glycine/SDS)
25mM Tris base(三羟甲基氨基甲烷游离碱)
190mM 甘氨酸
0.1% SDS
测定 pH 值并将 pH 值调整至 8.3
转膜缓冲液(湿转)
25mM Tris base (三羟甲基氨基甲烷游离碱)
190mM 甘氨酸
20% 甲醇
测定 pH 值并将 pH 值调整至 8.3
对于大于 80 kDa 的蛋白,建议 SDS 终浓度为 0.1%。
转膜缓冲液(半干转)
48mM Tris base
39mM 甘氨酸
20% 甲醇
0.04% SDS
封闭缓冲液
3–5% 牛奶或 BSA(牛血清白蛋白)
加入 TBST 缓冲液。充分混合后过滤。不过滤可能会有斑点沉积,这种小暗点会在显色时影响实验结果。
样本裂解
细胞培养裂解液的制备
将细胞培养皿放置冰上并用冰冷的 PBS 洗涤细胞。
吸出 PBS,然后加入冰冷的裂解缓冲液(每 107 个细胞/100 mm 培养皿/150 cm2 烧瓶加 1 mL;每 5x106 个细胞/60 mm 培养皿/75 cm2 烧瓶加 0.5 mL)。
用预冷的塑料细胞刮刀将贴壁细胞从培养皿上刮下,然后轻轻将细胞悬液转移到预冷的小离心管中。或者,用胰蛋白酶消化细胞并用 PBS 洗涤细胞,然后将细胞重悬浮于小离心管内的裂解缓冲液中。
4℃ 下持续振摇 30 分钟。
放入微型离心机,在 4°C 下离心。您可能需要根据细胞类型改变离心力和离心时间;指南给出的参考标准是在 12,000 rpm 转速下离心 20 分钟,但须根据您的实验确定(白细胞所需的离心力很小)。
轻轻地从离心机中取出离心管放置在冰上。将上清液吸出转移到放置在冰上预冷的新管中,弃去沉淀。
组织裂解液的制备
3.1 用干净器械解剖目标组织,最好在冰上,并且越快越好以防蛋白酶降解。
将组织放入圆底离心管或 Eppendorf 管中,浸入液氮中“速冻”。样本在 -80°C 储存备用,或放在冰上立即匀浆。对于一块约 5 mg 的组织,向管中迅速加入约 300 μL 裂解液,并用电动匀浆器匀浆,2X 裂解液冲洗刀片两次,每次 200 μL,然后在 4℃ 下(例如将回旋振荡器放入冰箱)持续振摇 2 小时。裂解液的体积必须根据组织总量决定;蛋白提取物不宜过稀释,以免造成蛋白损失,并尽量减少样本体积,以便凝胶上样。最小浓度为 0.1 mg/mL,最佳浓度为 1-5 mg/mL。
在微型离心机中 4℃ 下按照 12,000 rpm 的转速离心 20 分钟。轻轻地从离心机中取出离心管放置在冰上。将上清液吸出转移到放置在冰上预冷的新管中,弃去沉淀。
样本制备
取少量裂解液,用于蛋白质定量分析。测定每种细胞裂解液的蛋白质浓度。
确定蛋白质的上样量,并添加等体积的 2X 稀释 Laemmli 样本缓冲液。我们建议使用以下方法对样本进行还原和变性,除非在线抗体数据表显示应使用非还原和非变性条件。
对样本进行还原和变性时,将样本缓冲液中的细胞裂解液在 100°C 下煮沸 5 分钟。裂解液可等量分装并在 -20°C 下储存备用。
上样和跑胶
3.1 将等量的蛋白和分子量标志物上样至 SDS-PAGE 凝胶孔中。细胞裂解液或组织匀浆的总蛋白上样量为 20-30 μg,纯化蛋白的上样量为 10-100 ng。
3.2 在 100 V 下跑胶 1-2 小时。
时间和电压可能需要优化。我们推荐按照制造商的说明进行操作。建议使用还原型凝胶,除非抗体数据表推荐使用非还原性条件。
凝胶百分比取决于目标蛋白的大小:
蛋白大小 | 凝胶百分比 |
4–40 kDa | 20% |
12–45 kDa | 15% |
10-70 kDa | 12.5% |
15-100 kDa | 10% |
25-100 kDa | 8% |
也可以使用梯度凝胶。
蛋白从凝胶转移到膜
膜可以是硝酸纤维素,也可以是 PVDF。用甲醇活化 PVDF 1 分钟,并在制备转膜层之前用转膜缓冲液冲洗 PVDF。转膜时间和电压可能需要优化。我们推荐按照制造商的说明进行操作。可在封闭步骤之前用丽春红染色法检查蛋白质转膜。
转膜层的制备如下:

图 1.制备好的转膜层示例。
抗体染色
用封闭缓冲液在室温下封闭膜 1 小时或在 4°C 下封闭过夜。
用适当稀释的一抗在封闭缓冲液中孵育膜。我们建议在 4°C 下过夜孵育;其他条件可以优化。
用 TBST 洗涤膜 3 次,每次 5 分钟。
用推荐稀释度的偶联二抗在封闭缓冲液中室温孵育膜 1 小时。
用 TBST 洗涤膜 3 次,每次 5 分钟。
产生信号时,请遵循试剂盒生产商的建议。除去多余的试剂,并用透明塑料膜覆盖膜。
利用暗室显影技术采集化学发光图像,或利用常规图像扫描法采集比色检测图像。
相关链接
查看所有 Abcam 内参对照。
示例内参对照:ab8227 beta actin
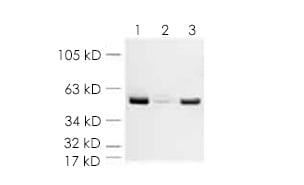
所有泳道:beta Actin 抗体 - 内参对照 (ab8227),稀释度为 1/5000
泳道 1:HeLa 全细胞提取物
泳道 2:酵母细胞提取物
泳道 3:小鼠脑组织裂解液
查看蛋白质印迹中表现出色的 AbExcel 二抗。
实验方案由 Abcam 根据 Abcam 实验室使用 Abcam 试剂和产品开展的实验“按原样”提供;在其他条件下使用实验方案得出的结果可能会有所不同。
网络研讨会记录
Western blot 的目的在于按照分子量大小在凝胶上分离蛋白。然后将蛋白转移到膜上,从而使用抗体对蛋白进行检测。在含有还原剂(如 β-巯基乙醇)的样本缓冲液中,95 ℃ 下加热样本 5 到 10 分钟。这样可以让线性化蛋白带上与其大小成正比的负电荷。
将凝胶放入电泳槽中并加入缓冲液,确保孔的顶部被缓冲液覆盖。所用凝胶的丙烯酰胺百分比取决于靶蛋白的分子量。将分子量标志物上样至第一泳道,然后将样本上样至相邻的孔中。所有样本均含有等量蛋白。所有样本完成上样后,添加电泳缓冲液,给电泳槽盖上盖子。打开电源,按照制造商的推荐设置凝胶槽中凝胶的电压。这时应该能够看到凝胶槽中有上升的气泡。跑胶,直到染料前沿充分移动至凝胶。
下一阶段是将蛋白从凝胶转移到膜。膜通常由硝化纤维或 PVDF 制成。从凝胶槽中取出凝胶,并小心地将它从塑料盒中释放。切断孔和凝胶脚,并将凝胶放入转膜缓冲液中。将膜和凝胶夹在滤纸和海绵之间,制备转膜层。膜应靠近正极,凝胶应靠近负极。使用小滚筒去除凝胶和膜之间的气泡。夹住关闭的转膜箱,并将它浸入含有转膜缓冲液的转膜槽中。向外室加水,以保持系统冷却,并盖上盖子。打开电源,开始转移蛋白。时间和电压需要优化,请查看制造商的说明。
现在蛋白已经从凝胶转移到硝酸纤维素膜上了,可以用抗体检测目标蛋白了。膜可以从盒中取出,现在应该可以看到分子量标志物了。如有需要,可以用丽春红 S 溶液对膜进行染色,从而确认蛋白质的转移。为了防止抗体发生非特异性结合,需要封闭膜。将封闭缓冲液倒在膜上,并置于摇床上轻轻摇动。通常情况下,需要使用 5% 牛奶或牛血清白蛋白(BSA)溶液在室温下孵育两小时或 4℃ 下孵育过夜。应优化封闭缓冲液的时间和类型,请查看您打算使用的一抗的数据表,了解详细信息。
膜封闭后,去除封闭缓冲液,在同一溶液中加入稀释的一抗。与之前一样,置于摇床上孵育。通常会在室温下孵育一抗 1 小时或 4℃ 下孵育过夜。抗体浓度和孵育时间需要优化。如需任何指导,请查阅抗体数据表。倒出一抗,用洗涤缓冲液冲洗膜两次。随后在摇床洗涤膜 1 次,时长 15 分钟,再洗涤膜 3 次,每次 10 分钟。洗涤缓冲液通常是含 0.1% 吐温 20 的 Tris 缓冲盐溶液(TBS)或磷酸盐缓冲盐溶液(PBS)。
倒掉洗涤缓冲液,在偶联二抗中孵育膜,二抗需先在封闭缓冲液中稀释。通常要在室温下孵育一小时,但抗体浓度和孵育时间需要优化。倒掉二抗,并按照上述步骤清洗膜。
有几种不同的检测系统。如果二抗与酶偶联,则成像前,应在合适的底物中孵育膜。如果二抗是荧光偶联二抗,可以直接进入成像步骤。成像时使用 X 射线胶片或数字成像系统。将膜放入成像托盘中。将成像托盘放入成像系统。为了清楚地检测与目标蛋白相关的条带,可能需要优化曝光时间。
 会员中心
会员中心



